Termodinâmica Cap 8 Entropia Parte 2 YouTube

Entropía Los cambios químicos y físicos en un sistema pueden estar acompañados por un aumento o una disminución en el trastorno del sistema, correspondiente a un aumento en la entropía (ΔS> 0) o una disminución en la entropía (ΔS 0), respectivamente .Como con cualquier otra función de estado, el cambio en la entropía se define como la diferencia entre las entropías de los estados.
Balances de entropía en sistemas abiertos YouTube
Por la misma lógica, el proceso recíproco (congelación) exhibe una disminución en la entropía, ΔS <0. Figura 16.2.4 16.2. 4: La entropía de una sustancia aumenta (ΔS> 0) a medida que se transforma de un sólido relativamente ordenado a un líquido menos ordenado y luego a un gas aún menos ordenado.
Termodinámica. Cálculo de entropía. Problema 35 YouTube

En 1824, a la edad de 28 años, Nicolas Léonard Sadi Carnot (Figura \(\PageIndex{2}\)) publicó los resultados de un extenso estudio sobre la eficiencia de las máquinas de calor de vapor.En una revisión posterior de los hallazgos de Carnot, Rudolf Clausius introdujo una nueva propiedad termodinámica que relaciona el flujo de calor espontáneo que acompaña a un proceso con la temperatura a.
APRENDAMOS SOBRE LA MATERIA CAMBIOS DE ESTADO
Determinación Del Cambio de Entropía en Una Disolución de Urea | PDF | Entropía | Entalpía. Scribd es red social de lectura y publicación más importante del mundo.
Física II Entropía YouTube

Determinación de ∆ H ,∆S Y ∆G para la disolución de urea Valdez Morales Juan Ramón. La disolución de urea sólida en agua es un proceso endotérmico, que ocurre también con un aumento en el grado de desorden de un sistema (entropía) en su grado de homogeneidad y sucede de forma espontánea. Palabras clave: Entropía, Energía libre de Gibbs, Entalpía, Disolución, Homogeneidad.
👍TERMODINÁMICA. ENTROPÍA. CÁLCULO de la ENTROPÍA de VARIOS CUERPOS que CAMBIAN DE TEMPERATURA Y

Cambios de fase. El cambio de entropía para un cambio de fase a presión constante viene dado por. ΔS = q T = ΔHphase T. Ejemplo 5.4.2: Entropy Change for Melting Ice. La entalpía de fusión para el agua es de 6.01 kJ/mol. Calcular el cambio de entropía para 1.0 mol de hielo que se derrite para formar líquido a 273 K. Solución.
Cambio de entropia ejercicio resuelto Fisicoquímica YouTube

El SI unidad para la entropía es J / K . Según Clausius, la entropía se definió mediante el cambio en la entropía S de un sistema. El cambio en la entropía S, cuando se le agrega una cantidad de calor Q mediante un proceso reversible a temperatura constante, viene dado por: Aquí Q es la energía transferida como calor hacia o desde el.
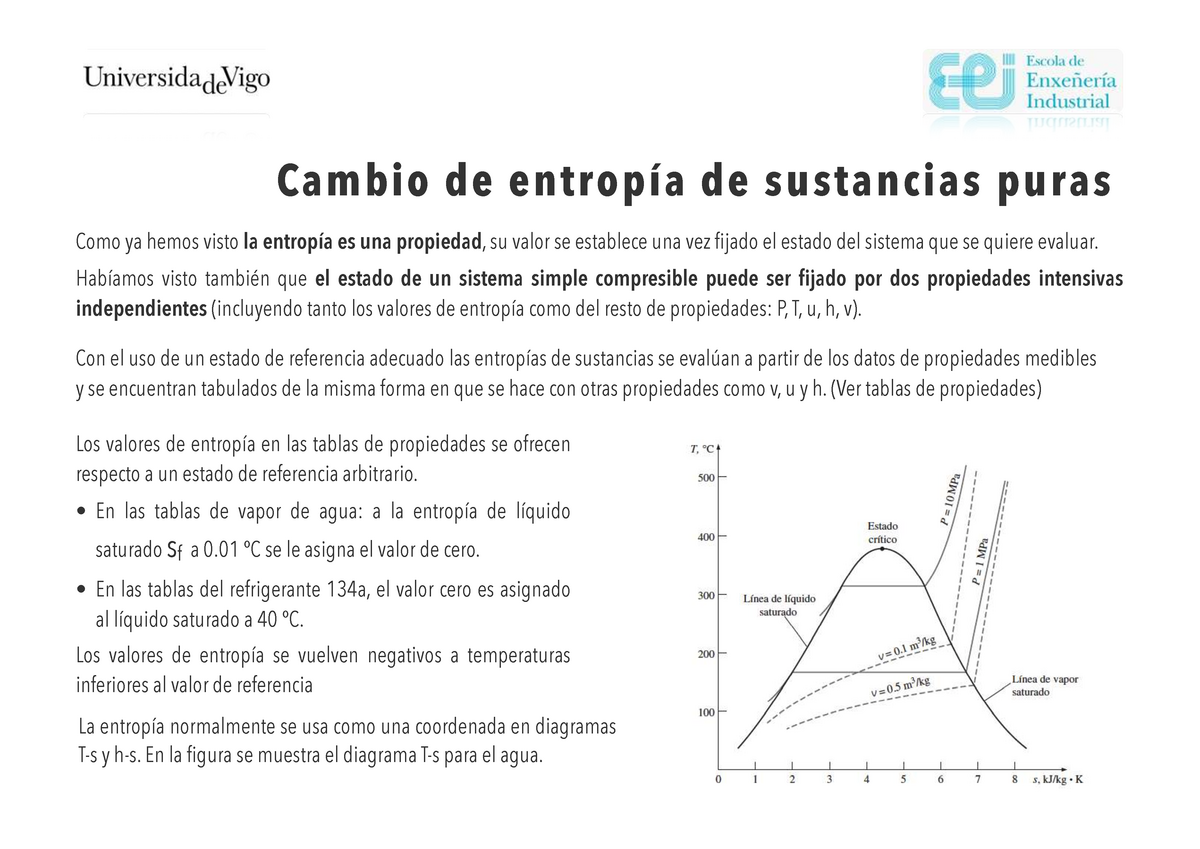
TTC 6. Entropia 2 AÑO 20202021 Cambio de entropía de sustancias puras Como ya hemos visto
La variación de entropía en estas transformaciones se calcula como: Cuando decimos cambios de entropía "debido solamente a la transferencia de calor para procesos a temperatura constante" que lo único que sucede es que absorbe o libera calor. En estos casos podemos incluir los cambios de estado, las evoluciones isotérmicas, las fuentes.
CAMBIO de ENTROPÍA para sustancias 764 TERMODINÁMICA CENGEL 9na edición. YouTube

VIDEO ANSWER: Cómo cambia la entropía de un sistema para cada uno de los siguientes procesos? a) Un sólido se funde. b) Un líquido se congela. c) Un liquido hierve. d) Un vapor se convierte en un sólido. e) Un vapo
LOS ESTADOS DE LA MATERIA
El fascinante mundo de la entropía: desentrañando el misterio detrás de la fusión de sólidos. La entropía es un concepto fundamental en la física y la química que nos permite comprender la dirección en la que ocurren los procesos naturales.
Bioprofe Química Cambios de estado de la materia

Ejemplo de variación de entropía en un cambio de estado. Hagamos el ejercicio planteado a manera de práctica. 1. 24 gramos de amoníaco están siendo vaporizados en su punto de ebullición, a unos -33,34ºC. ¿Cuánto variará la entropía del sistema cuando se realiza dicho experimento, sabiendo que el calor latente de vaporización del.
TERMODINÁMICA. ENTROPÍA. ¿CÓMO CALCULAR la ENTROPÍA de un PROCESO DESCONOCIDO? [ENTRA y ENTÉRATE

En 1824, a la edad de 28 años, Nicolas Léonard Sadi Carnot (Figura 16.7) publicó los resultados de un amplio estudio sobre la eficacia de las máquinas térmicas.Una revisión posterior de los hallazgos de Carnot por parte de Rudolf Clausius introdujo una nueva propiedad termodinámica que relaciona el flujo de calor espontáneo que acompaña a un proceso con la temperatura a la que este.
La entropia y la muerte del universo
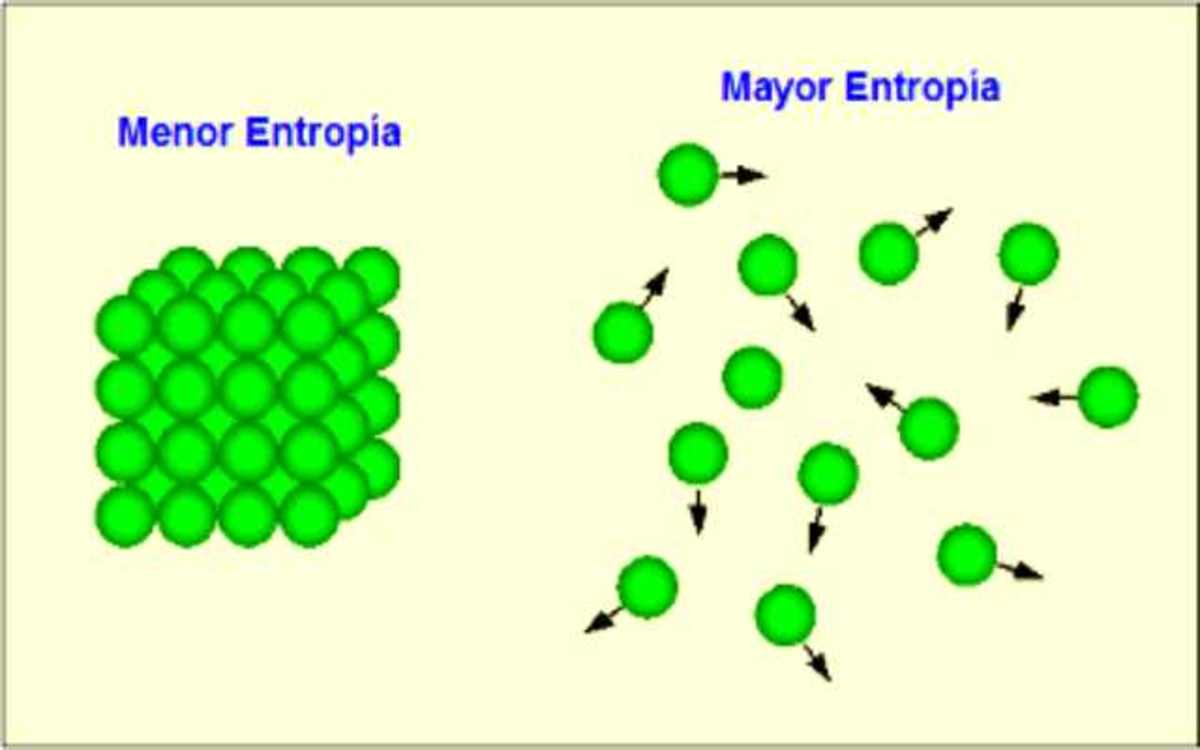
La segunda ley de la termodinámica deja claro que la entropía del universo nunca disminuye durante ningún proceso termodinámico. Para cualquier otro sistema termodinámico, cuando el proceso es reversible, el cambio de la entropía viene dado por Δ S = Q / T Δ S = Q / T.Pero, ¿qué pasa si la temperatura llega a cero, T → 0 T → 0?Resulta que esta no es una pregunta que pueda.
TERMODINÁMICA. INTERESANTE CÁLCULO DE LA CALIDAD CUANDO SÓLO SE CONOCE LA ENERGÍA INTERNA Y

Trabajo y reversibilidad. Para un proceso que intercambia reversiblemente una cantidad de calor q rev con el entorno, el cambio de entropía se define como \[ \Delta S = \dfrac{q_{rev}}{T} \label{23.2.1}\] Esta es la forma básica de evaluar Δ S para procesos de temperatura constante como los cambios de fase, o la expansión isotérmica de un gas. Para procesos en los que la temperatura no es.
Cambio de Entropía en Sustancias Puras Ejemplo 2 (735 Termodinámica Cengel) YouTube

La entropía (S) es una medida de la cantidad de desorden o aleatoriedad en un sistema. Se puede pensar en ella como una medida de la 'dispersión' de la energía en el sistema. Esta se mide en unidades de energía divididas por temperatura, como julios por kelvin (J/K). La relación entre ambas se expresa en la segunda ley de la termodinámica.
Entropía YouTube

Cómo Cambia La Entropía | PDF | Cristalización | Condensación. Scribd es red social de lectura y publicación más importante del mundo.
.